我可以使用哪些实验室诊断方法来诊断PRRS?我应该根据情况选择哪一个?如何解释结果?
可用分析
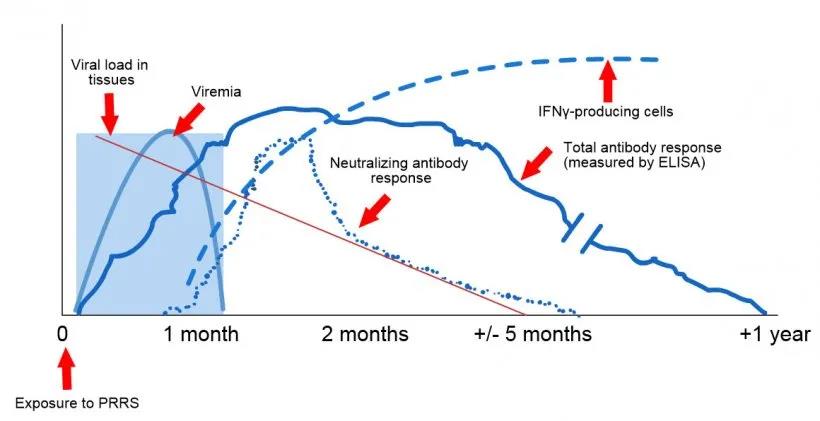
暴露于PRRS后的病毒和抗体检测示意图:下图显示了测定中使用的不同分析物的浓度(Y轴)随时间(X轴)的变化。暴露于PRRS病毒后,会在猪的血液中发现病毒(病毒血症),这种病毒通常持续2至4周,具体时间取决于猪的年龄和免疫状况。血清转化(抗体检测)通常发生在暴露后7至10天之间,持续数月后才变为血清阴性。中和抗体在暴露后4至6周出现(López和Osorio,2004)。
聚合酶链反应(PCR)
检测病毒核酸(RNA)特定序列的存在。
样本类型:组织,全血,血清,口腔液体等。
优点:
通常可以同时检测5个血清或组织样本以降低成本,同时最大程度地降低灵敏度损失。
由于预期的较高Ct值(较低的病毒浓度),通常不合并口腔液体,这可能会导致敏感性显着下降。
使用单独的引物同时检测同一样品中的PRRS 1型(欧洲)和2型(北美)。
灵敏度高(可以检测到少量病毒)。
早期发现-急性病例应为阳性。
可以使用许多不同的样本类型(组织,血液,血清,口腔液体等)。
成本适中:
缺点:
PRRS 1型和2型引物都必须更新。
实验室必须定期更新引物以避免假阴性。
测序需要区分疫苗病毒和野生型感染。
酶联免疫吸附测定(ELISA)
检测抗体的存在。
样品类型:血清或口腔液体(某些试剂盒)。
优点:
大多数可检测PRRS 1型和2型抗体。
动物保持阳性数月(3-12个月)。
可用于慢性病例。
缺点:
各种可用的商品试剂盒之间,检测到的特异性抗体和检测时间可能略有不同。
动物血清阳性需要7到10天。
无法区分母源抗体与暴露。
无法区分疫苗与野生型感染。
免疫组织化学(IHC)
检测病毒抗原的存在。
样本类型:组织。
优点 :
病变部位检测病毒(良好的病因证明)。
可以识别病毒的低、中、高含量。
缺点 :
必须提交正确的组织样本。
与PCR相比,需要更多的病毒存在。
仅可评估少量的组织样本。
基因测序
测序病毒的核酸基因(RNA)。
测序病毒的核酸基因(RNA)。
优点:
可以区分野生型病毒和疫苗。
可以帮助区分新病毒的引入与现有或过去的病毒。
缺点:
昂贵。
通常仅对ORF5进行测序,其仅为约15,000个碱基对中的600个。
CT值大于34的样本往往难以测序。
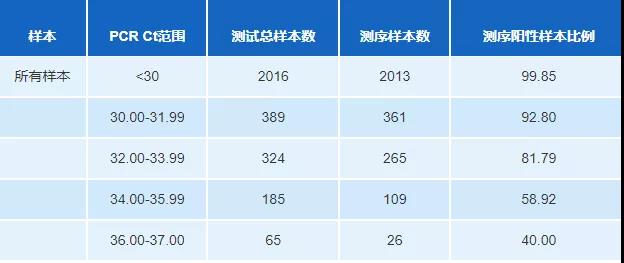
表1:爱荷华州立大学兽医诊断实验室基于口腔液体样品中PRRS PCR循环阈值(Ct)值的序列成功率。Chris Rademacher等人,2016
间接荧光抗体(IFA)
检测抗体的存在。
样品类型:血清。
优点:
与PCR测试一起,可以用作意外ELISA阳性样品的确认测试。
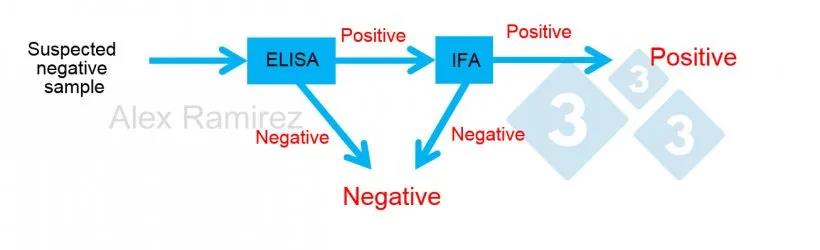
图示说明使用PRRS IFA对PRRS ELISA意外阳性的样品进行确认试验。疑似阴性样品的ELISA检测为阴性,则视为阴性。如果该样本意外呈阳性,则可进行PRRS IFA确认试验。也就是说,如果IFA测试是阳性的,则确认样品是阳性的。如果IFA试验是阴性的,只要PCR也是阴性的,我们就假设它是假阳性,以便确认最近没有感染。
缺点:
对于大量样品不可行。
用于分析的病毒分离物对结果的影响。
可靠性高度依赖于技术人员的技能。
结果解释
PCR
阳性-病毒存在/传播高度提示病因,尤其是Ct值较低且存在临床症状。最近用改良活病毒接种疫苗可导致PCR阳性。
阴性-如果在感染后期进行检测,则可能会呈阴性或未检测到病毒。
ELISA
阳性-母源抗体或过去接触疫苗或野生型病毒(通常在接触后7-10天以上)。
阴性-阴性或感染初期以至于无法检测到(通常必须在暴露后至少7-10天)。
IHC
阳性–病变部位存在病毒。
阴性-如果在感染后期进行检测,则可能会呈阴性或未检测到病毒。
基因测序
疫苗病毒–预期同源性>99%。
野生型病毒-估计每年约有1-2%的同源性损失。
IFA
阳性-母源抗体或过去接触疫苗或野生型病毒(通常在接触后7-10天以上)。
阴性-阴性或感染初期以至于无法检测到(通常必须在暴露后至少7-10天)。
场景
母猪/后备母猪流产
流产的胚胎:收集6-8个胚胎合并进行PCR测试。流产的胚胎中只有大约50%的PCR阳性(因此需要对许多胚胎进行采样),但是阳性胚胎中病毒的浓度很高,因此可以每10个一组进行PCR检测。
流产的母猪/后备母猪:收集最近流产(<10天)的母猪/后备母猪的血清以进行PCR测试。可以每5组一起进行测试。ELISA测试没有用,因为母猪/后备母猪通常需要7到9天才能检测出阳性。
母猪/后备母猪繁殖问题
从受影响的母猪/后备母猪收集15至20个样品,从未受影响的母猪/后备母猪收集15至20个样品,并通过PCR(5个或6个一组)和ELISA(单独)进行测试。
分娩时的弱小仔猪
可以从有较弱仔猪的窝中收集群体口腔液体,并通过PCR进行测试。
可以在产房从不同窝的猪中收集睾丸(如果进行阉割),尾巴,舌头组织(死猪)。可以将大量样本集中在一起进行测试。
通过每窝收集2至3头仔猪,收集10窝受影响仔猪的血清样品,并通过PCR进行测试,每组5-6头仔猪。确保仔猪未进行PRRS疫苗接种。
具有PRRS急性临床体征的生长猪
从4到6个不同猪栏中收集口腔液体,并通过PCR分别进行测试。不要合并样本进行测试。
从具有临床体征的猪中或随机取样,采集30份血清样品,并通过PCR进行测试。可以以5个或6个为一组进行PCR测试。还可以通过ELISA测试单个样品以确认暴露。
来源:Pig333





